2月13日,国家食品药品监督管理总局(CFDA)在其网站上发布“总局办公厅公开征求《关于进口药品注册审评审批有关事项的公告(征求意见稿)》意见”(以下简称“征求意见稿”),就公告内容在3月2日前征求意见。
笔者将该文件与2009年发布的《关于进口药品再注册有关事项的公告(国食药监注[2009]18号)》(以下简称“18号文件”)逐一比较,见下表:
| 关于进口药品注册审评审批有关事项的公告(征求意见稿) | 关于进口药品再注册有关事项的公告(国食药监注[2009]18号) |
| 一 | 本公告发布之日起,进口药品再注册申请受理后,全部资料转交国家食品药品监督管理总局药品审评中心审评审批。 | 关于再注册核档程序事项 (一)属于下列情形的进口药品再注册,申请人可以申请再注册核档程序:(下略) (二)……对申请再注册核档程序的品种,受理中心在受理后,应当将全部资料转交中国药品生物制品检定所(以下简称中检所)。 未注明上述内容的再注册申请,受理中心将按照一般程序,将全部资料转交国家食品药品监督管理局药品审评中心(以下简称药审中心)。 (三)进口药品再注册申请的核档工作由中检所承担。中检所在收到受理中心转交的进口药品再注册申请资料后,应当在40个工作日内,完成对该品种原始档案的核对工作,填写《进口药品再注册申请核档意见表》(附件1),与再注册申请资料一并送国家食品药品监督管理局药品注册司。 (四)(内容略) (五)国家食品药品监督管理局药品注册司根据中检所的核档意见进行审查,符合核档程序要求的,办理进口药品再注册审批手续;不符合核档程序要求,中检所将其全套技术资料转交药审中心进行技术审评,审评时限为100个工作日。 |
| 二 | 已受理的进口药品再注册申请,包括进口再注册核档意见为无需质量标准复核的注册申请,统一转入国家食品药品监督管理总局药品审评中心进行审评审批。 |
| 三 | 《进口药品注册证》《医药产品注册证》实施新的编号模式: | 关于再注册和补充申请注册证编发等事项 |
| 1 | 进口药品再注册批准后,原注册证收回注销,核发新的《进口药品注册证》或《医药产品注册证》(以下简称核发新证)。其注册证号保持原注册证号,不再重新编号,注册证有效期为自批准之日起5年有效。每个注册证仅收载1个规格,并最多收载2个包装规格。 | 进口药品再注册批准后,核发新的《进口药品注册证》或《医药产品注册证》,原注册证尚处于有效期内的,国家食品药品监督管理局予以收回注销。 注册证书的编号格式按照《药品注册管理办法》的规定执行。每个注册证仅收载1个规格,并最多收载2个包装规格。
|
2
| 进口药品分包装用大包装再注册批准后,原注册证收回注销,核发新证。其注册证号保持原注册证号,不再重新编号,注册证有效期与小包装规格的注册证有效期相同。并在备注项注明专供国内药品生产企业分包装用的内容。 | 进口药品分包装用大包装《进口药品注册证》或《医药产品注册证》单独核发,并在备注项注明专供国内药品生产企业分包装用的内容。 再注册批准后,核发新的大包装《进口药品注册证》或《医药产品注册证》,原注册证尚处于有效期内的,国家食品药品监督管理局予以收回注销。 注册证号的编号格式,按照小包装的《进口药品注册证》或《医药产品注册证》编号格式编发,不再实行在原注册证号前加B的方式。注册证有效期限与小包装规格的注册证的有效期限相同。
|
| 3 | 改变产地(实际地址变更)的补充申请批准后,原注册证收回注销,核发新证。其注册证号保持原注册证号,不再重新编号,注册证有效期为自批准之日起5年有效。 | 对于改变产地的补充申请,核发新的《进口药品注册证》或《医药产品注册证》,原注册证收回注销,其注册证号按批准时所在年份的顺序重新编号,注册证有效期限为自批准之日起5年有效。 |
| 4 | 对于增加规格的补充申请批准后,核发新证。其注册证号按批准时所在年份的顺序重新编号,注册证有效期限仍为原注册证的有效期。 | 对于增加规格的补充申请,核发新的《进口药品注册证》或《医药产品注册证》,其注册证号按批准时所在年份的顺序重新编号,注册证有效期限为自批准之日起5年有效。 |
| 5 | 对于增加包装规格和分包装用大包装规格的补充申请批准后,核发新证。其注册证号按批准时所在年份的顺序重新编号,注册证有效期限仍为原包装规格注册证的有效期。 | 对于增加包装规格和分包装用大包装规格的补充申请,核发新的《进口药品注册证》或《医药产品注册证》,其注册证号按批准时所在年份的顺序重新编号,注册证有效期限仍为原包装规格注册证的有效期限。 |
| 6 | 变更公司和生产厂名称、地址名称(生产厂实际生产地址不变)、变更包装规格以及变更药品名称等的补充申请批准后,原注册证收回注销,核发新证。其注册证号保持原注册证号,不再重新编号,注册证有效期限仍为原注册证的有效期。 | 对于变更公司和生产厂名称、地址名称(生产厂实际地址未变)以及变更药品名称等的补充申请,核发新的《进口药品注册证》或《医药产品注册证》,原注册证收回注销,其注册证号按批准时所在年份的顺序重新编号,注册证有效期限仍为原注册证的有效期限。 |
| 7 | 其他由国家食品药品监督管理总局审批的补充申请事项,一律以《药品补充申请批件》的形式批准,不核发新证。 | 其他由国家食品药品监督管理局审批的补充申请事项,一律以《药品补充申请批件》的形式批准,不核发新证。 |
| 8 | 进口药品在中国国内分包装的补充申请(非首次申请)批准后,以《药品补充申请批件》的形式批准,药品批准文号保持原药品批准文号。 |
|
| 四 | 对本公告中未涉及的事项,仍按照现有规定执行。 |
|
与“18号文件”相比,“征求意见稿”的改动为两类:
一是取消进口药品再注册核档程序
按照2009年的文件,进口药品再注册的程序分为两类:符合再注册核档程序的和不符合再注册核档程序的。
根据“18号文件”,属于下列情形的进口药品再注册,申请人可以申请再注册核档程序:
1.再注册申请时,其药品处方、生产工艺、质量标准、原辅料来源、直接接触药品的包装材料、说明书和包装标签等与上次注册时未发生任何变更的;或已发生变更,但该变更的补充申请已经按照《药品注册管理办法》的规定,得到国家食品药品监督管理局批准或者已经备案完毕的;
2.公司和生产厂的名称和地址名称变更、药品名称变更等无技术审评内容的;
3.增加或者完善说明书安全性内容的;
4.缩短药品有效期的;
5.其他由国家食品药品监督管理局直接备案的事项
依据CFDA发布的“进口药品再注册审批事项服务指南”,符合再注册核档程序的申请由中共食品药品检定研究院进行核档,其流程和所需时间如下:
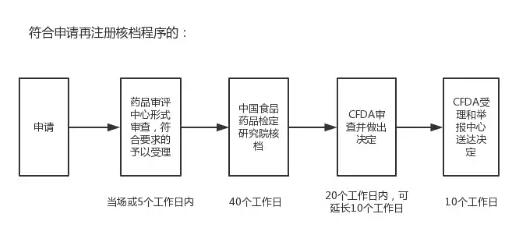
而不符合申请再注册核档程序的,则需要CFDA药品审评中心进行技术审评,流程和所需时间如下:
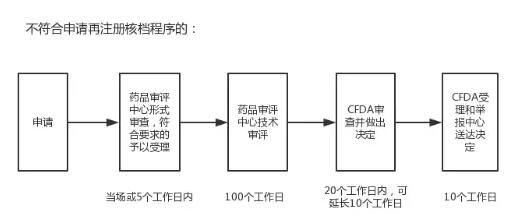
“征求意见稿”取消了进口药品再注册核档程序,申请受理后,全部资料转交审评中心审评审批。也就是说,全部按照之前“不符合申请再注册核档程序的”流程进行。文件没有提及审评时限的变化。
第二个改变是针对《进口药品注册证》、《医药产品注册证》实施新的编号模式。
对于4类情况:
1.进口药品的再注册批准,
2.分包装用大包装再注册批准,
3.改变产地(实际地址变更)的补充申请
4.变更公司、生产厂名称、地址名称(生产厂实际生产地址不变),变更包装规格以及变更药品名称等的补充申请
注册证号保持原注册证号,不再重新编号。
还有一个有效期的改变。
对于增加规格的补充申请,原法规的有效期限为自批准之日起5年有效,现改为仍为原注册证的有效期。
新规旨在优化审批程序
这次征求意见稿,笔者以为,整体上是为了优化审批程序而做,以提高进口药品再注册审评审批的效率。
取消再注册核档程序后,无需中检院核档这一流程,统一由审评中心处理,使流程统一,有助于提高效率,也方便了申请企业。新编号模式,使得非药品实质性改变的申请,如变更包装、产地、名称等,与原先的注册证号保持不变,有助于管理和溯源。
增加规格的补充申请有效期改为原注册证的有效期,则更为科学和合理。(文章来源:网络)
以上就是进口药品注册代理公司-桐晖药业小编搜集整理的有关“进口药品注册审评审批的变化”的内容,供大家参考!一个周密、完善的临床试验应当能够很好地实现研究目的,客观、准确地量度重要的临床指标,避免或最低程度地降低各种偏倚和误差、机遇因素。
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!