1、参比制剂应提供几个批号?
答:根据总局2016年8月16日发布的第120号通告《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》:
1.1、质量考察: 每个规格原则上应提供3批(至少1批)参比制剂的考察数据;
1.2、溶出曲线考察:每个规格的参比制剂原则上应提供3批样品的溶出曲线考察数据;
1.3、溶出曲线稳定性考察:仅适用于理化性质不稳定品种,取1批参比制剂进行比较;
建议:购买3批参比制剂。
2、参比制剂的用量需要考虑的方面?
答:根据总局仿制药质量一致性评价办公室于16年7月21日举办的《仿制药质量和疗效一致性评价培训》讲课内容,企业除了开展药学研究、体外评价和体内评价所需参比制剂的使用量以外,还有2点需要考虑:
2.1、药检所复核检验所需的使用量;
2.2、完成临床试验后,临床试验机构仍需留样3年所需的使用量。
2.3、以上2.1和2.2还要注意微生物限度检查所需的用量。
参比制剂用量参考表
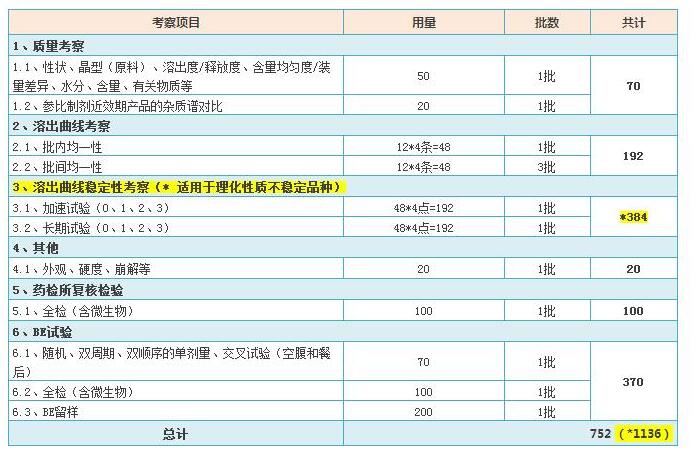
备注:以上只是粗略估计,仅供参考。
以上就是进口参比制剂代理公司-桐晖药业小编分享的有关“关于参比制剂用量的考虑”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询!