药物研究的本质就是通过研究来回答药物疗效、安全性方面的问题。药物临床试验是指在人体进行的、用于回答与研究药物预防或治疗相关的特殊问题的研究。
临床试验按照研究阶段分为Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验和Ⅳ期临床试验。
如果按研究目的划分,则可将临床试验分为临床药理学研究(HumanPharmacology)、探索性临床试验(Therapeutic Exploratory)、确证性临床试验(Therapeutic Confirmatory)、临床应用研究(Therapeutic Use)几种类型。
通常来说,I期临床试验是临床药理学研究,Ⅱ期临床试验是探索性研究,Ⅲ期临床试验是确证性研究,Ⅳ期临床试验是上市后的临床应用研究。但是,也存在特殊情况,见下图。两个分类系统相互关联,形成一个动态的临床试验网络。
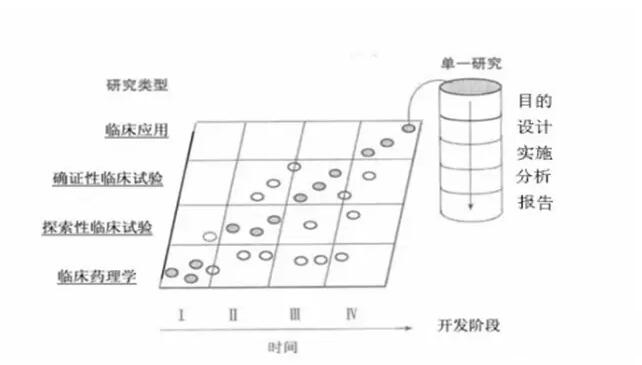
图为临床研发阶段与研究类型间的关系。实心圆代表在某一研究阶段最常进行的研究类型,空心圆代表某些可能但较少进行的研究类型。(图片来自国家食品药品监督管理总局药品审评中心发布《药物临床试验的一般考虑》)
临床药理学研究
临床药理学研究的目的是研究药物与人体的相互作用规律进而评价人体对药物的耐受性,明确药物动力学及药效学特征、毒副反应的性质和机制,探索药物代谢和药物相互作用,以及评估药物活性。因为临床药理学研究目的不是治疗,其可在健康志愿者或特定人群(包括患者)中进行。
临床药理学研究是后续一系列研究的基础,新药上市申请中对药物的安全性和有效性的评估必须要有临床药理学研究支持。临床药理学研究的内容主要包括药物对人体的效应(药效学和不良反应)、人体对药物的处置(药动学)、药物代谢及物质平衡、剂量-暴露量-效应关系、药物相互作用、药物基因组学、定量药理学、特殊人群的临床药理学、群体药代动力学等。
探索性临床试验
临床试验的早期,需要在患者中进行以探索有效性为目的临床试验,这是探索性临床试验的开始。探索性临床试验的目的是探索目标适应症在后续试验研究的给药方案,为药物有效性和安全性的确证性研究的研究设计、研究终点、方法学等提供基础,探索性临床试验也应有清晰和明确的目标。探索性试验有时需要更为灵活可变的方法进行设计并对数据进行分析,以便根据逐渐积累的结果对后期的确证性试验设计提供相应的依据。虽然探索性试验对有效性的确证有参考价值,但不能作为证明有效性的正式依据。
探索性临床试验通常对受试者进行严格筛选,以保证受试者人群的单一性,并对受试者进行严密监测。
探索性临床试验的一个重要目标是为确证性临床试验确定给药剂量和给药方案。早期探索性临床试验研究常采用剂量递增设计,以初步评价药物剂量与效应关系。针对所探讨的适应症,后期探索性临床试验常采用公认的平行组剂量效应设计。探索性临床试验所使用的药物剂量,通常低于临床药理学研究所提示的最大耐受剂量,如果高于该剂量,需要补做相应的临床药理学试验,以提供必要的支持。
探索性临床试验的其他目的包括对可能在下一步临床研究中设定的研究终点、治疗方案(包括合并给药)和目标人群(例如:轻度、重度疾患比较)的评价,这些目的可通过亚组数据和多个研究终点分析来实现,其分析结果可用于进一步的探索性临床试验或确证性临床试验。
确证性临床试验
确证性临床试验的研究目的是确证研究药物的有效性和安全性,为获益/风险关系评价提供依据,为获得上市许可提供足够的证据,同时确定剂量与效应的关系。对涉及药物有效性和安全性的每一个关键性的问题都需要通过确证性试验予以充分的回答。
确证性试验是一种事先提出假设并对其进行检验的随机对照试验,以说明所开发的药物对临床是有益的。在确证性试验中,最关键的假设检验应根据试验主要目的产生。主要假设检验应于试验开始前在试验方案中预先设定并于试验结束后严格按照预先设定完成。除此之外,在试验方案中还应阐明试验设计方法、统计分析方法及相关理由。确证性试验对于试验方案和标准操作流程的严格遵从是非常重要的。如果在试验过程中对方案有不可避免的修订,应给予说明并记载。对方案修订可能对结果产生的影响应予以评估。确证性试验还应对试验药物的疗效进行准确的估计。对于药物疗效的说明除了需要证明关键假设检验的统计学意义之外,还需要评估试验药物疗效具有临床意义。
当把确定治疗获益作为研究的首要目的时,可认为Ⅲ期临床试验开始。研究内容涉及剂量效应关系的进一步探索,或对更广泛人群、疾病的不同阶段,或合并用药的研究。确证性临床试验需要为完善药物说明书提供重要的临床信息。
临床应用研究
临床应用研究是上市后研究,其目的是进一步加强关于药物在普通人群、特殊人群或环境中的治疗受益-风险比关系的认识,发现少见不良反应,并为完善给药方案提供临床依据,进行上市后研究的另一目的是进一步拓宽药品的适应症范围。
根据研究的目的,临床应用研究可以分为两类:一是药品监管部门所要求的上市后研究。包括法规要求必须进行的上市后安全性临床研究和注册批件中要求完成的研究内容,其研究结果要求向药品监管部门报告。二是申请人或第三方承诺或自主实施的研究。药品上市后的有效性研究应针对上市前因样本量小和时间所限未能考察和解决的问题而进行研究,内容可包括药品远期疗效、具体给药方案、合并用药、对生命质量影响、对终点事件的干预程度等。药品上市后临床试验的安全性研究重点应放在发现新的、严重的不良反应,而不仅仅是已知和一般的不良反应。研究内容可包括:不良反应发生率、新的、严重的不良反应、不良反应类型、不良反应的严重程度和愈后、药物相互作用等。
以上就是广州临床研究机构-桐晖药业小编分享的有关“药物临床试验,有哪些类型?”的全部内容,供大家参考!
广州市桐晖药业有限公司是一家符合现代化管理要求的CRO公司,在进口原料药细分领域是为业界翘楚,为客户提供专业的药学研发、临床预BE、临床试验等临床评价服务,实现药学到临床一站式服务解决方案。目前的重点业务主要包括:原料药联合申报、参比制剂一次性进口、临床预BE/正式BE和一致性评价服务。如需合作,欢迎来电咨询。