据路透社消息,日本《每日新闻》周一报道,日本官员正在考虑是否允许盐野义株式会社(Shionogi & Co)最早在今年春天开始销售其治疗新冠的抗病毒药物S-217622。S-217622是一种口服3CL蛋白酶抑制剂,其作用机制与辉瑞获得FDA批准的COVID-19药片Paxlovid类似。

今日,盐野义公布了S-217622的II/III期临床试验IIa期部分数据。在抗病毒方面,与安慰剂组相比,S-217622组在以下各方面均有显著差异:
1)病毒滴度和病毒RNA迅速下降:
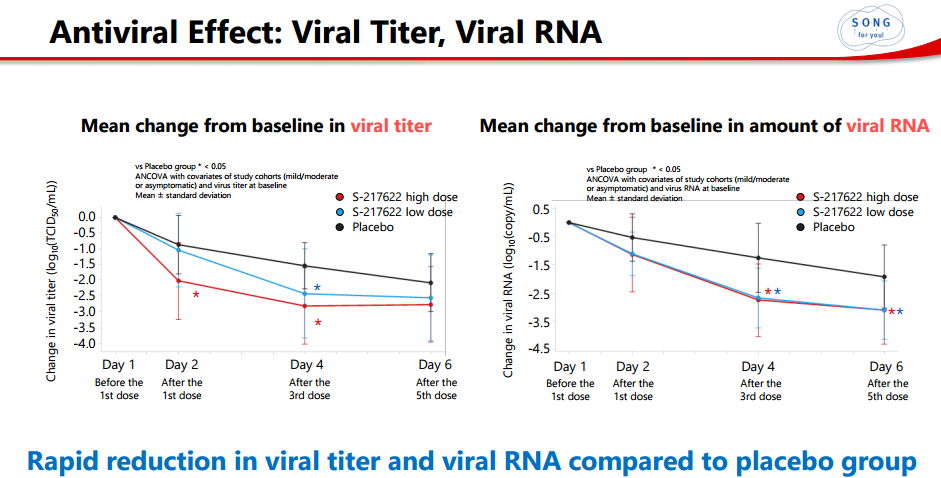
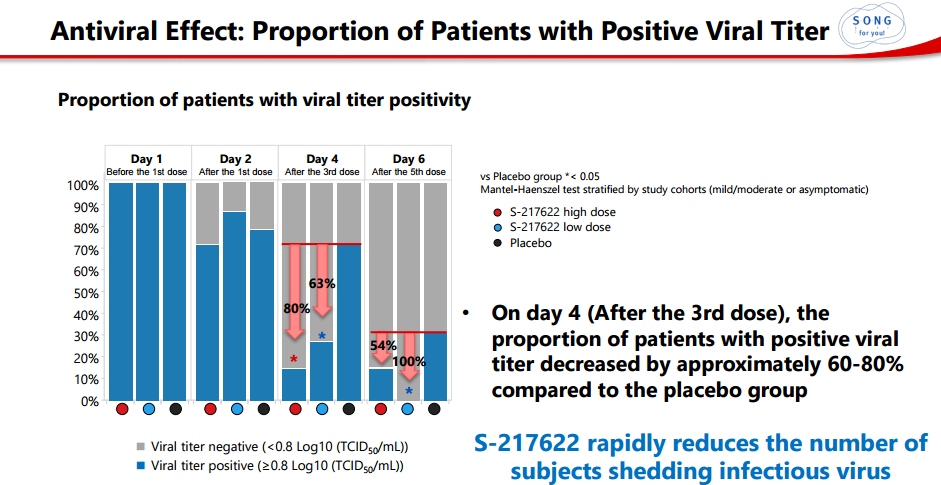
2)第4天(给予第三剂后),与安慰剂组相比,S-217622组病毒效价阳性受试者比例下降了约60-80%。
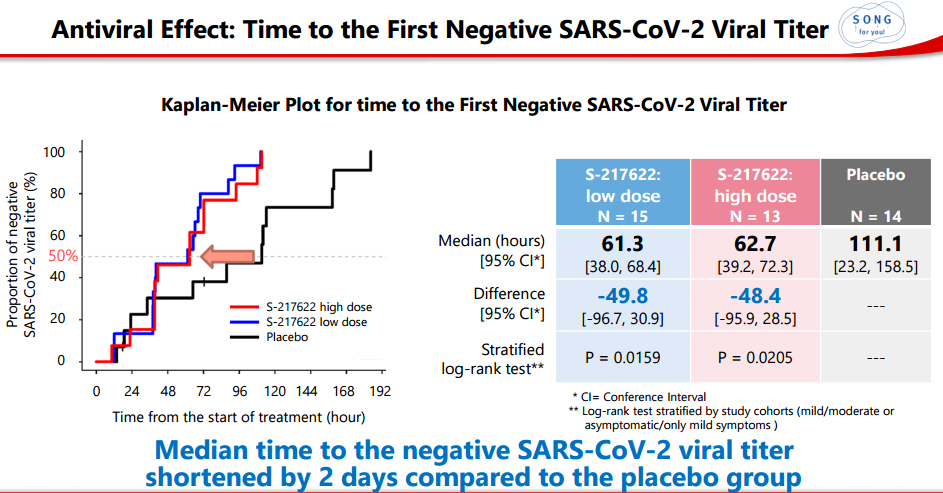
3)与安慰剂组相比,SARS-CoV-2病毒滴度转阴的中位时间缩短了2天。
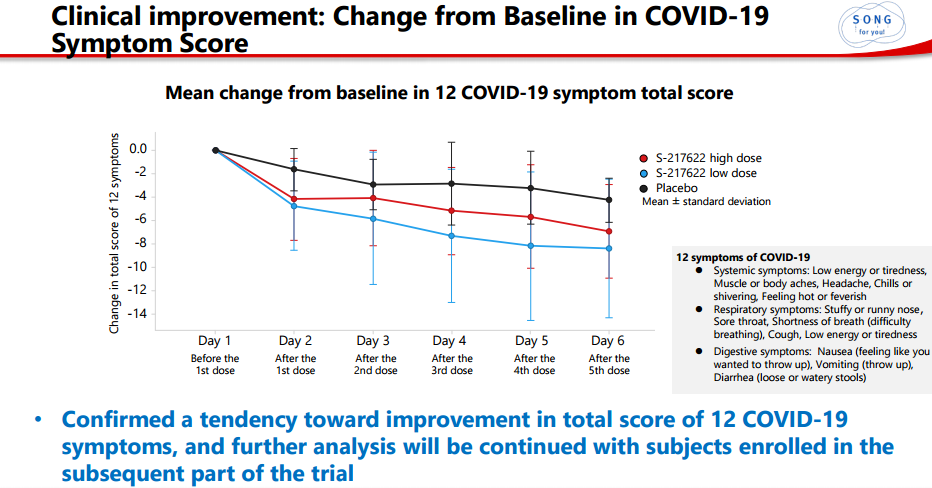
在临床症状改善方面,S-217622在12个COVID-19症状的总分方面表现出改善趋势,S-217622组中未发现需要住院或类似住院治疗的恶化病例。
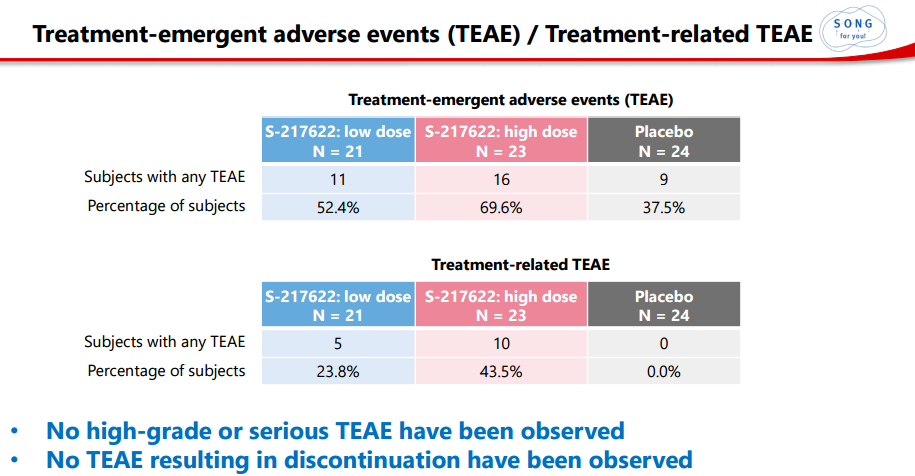
安全性方面,未观察到高级别或严重不良事件,无因不良事件导致停药事件,几乎所有治疗相关的TEAE都是轻微的。
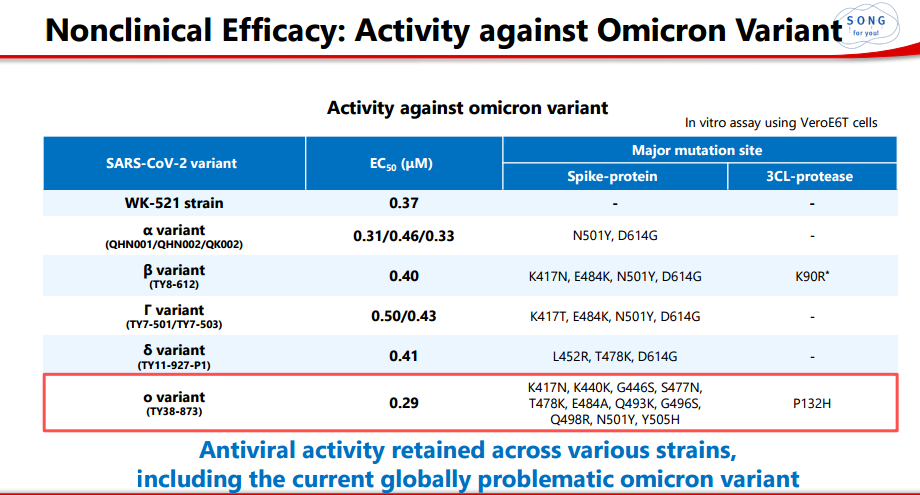
此外,非临床研究证明S-217622对omicron突变株有效。
据说,日本当局正在考虑是否允许该公司跳过临床研究的最后阶段,允许该药物在日本使用
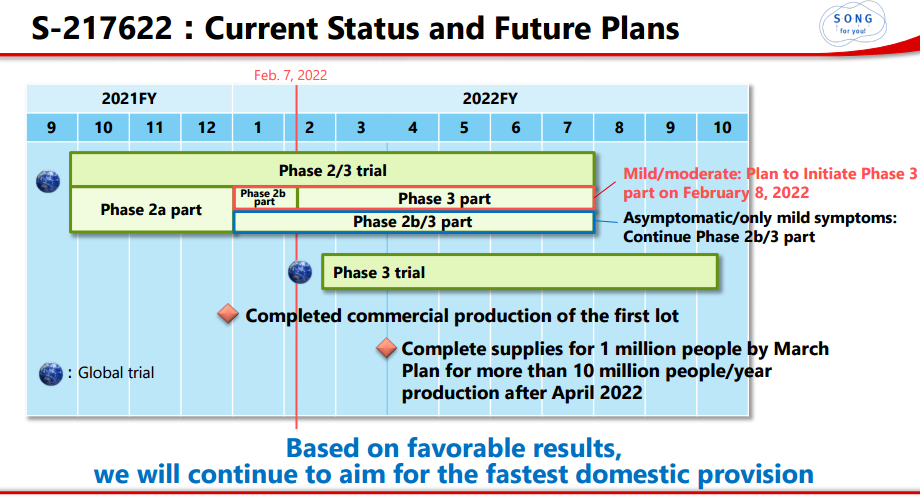
S-217622目前进展以及未来开发计划
几周前,辉瑞表示,已在日本递交Paxlovid的上市申请,以寻求日本监管机构的批准。Paxlovid是蛋白酶抑制剂nirmatrelvir和抗病毒药物利托那韦的组合。日本卫生大臣Shigeyuki Goto表示,日本已同意在年底前购买200万疗程Paxlovid。
去年12月,默沙东的molnupiravir在日本获得紧急情况特别批准,并且日本政府已同意采购约160万疗程的molnupiravir。