2021年,仿制药一致性评价进入密集收获期,全年共计435个品种通过一致性评价,其中,注射剂132个品种。
2016年3月5日,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号),标志中国仿制药质量和疗效一致性评价工作全面展开。2021年,随着仿制药一致性评价的常态化,相关政策大幅减少。
截止2021年12月30日,已上市仿制药一致性评价受理号总数达到3520个,注射剂一致性评价受理总数1621个。2021年,仿制药一致性评价承办的受理号共计884个,同比下降3.4%;通过的受理号数为1011个,同比增加85.8%。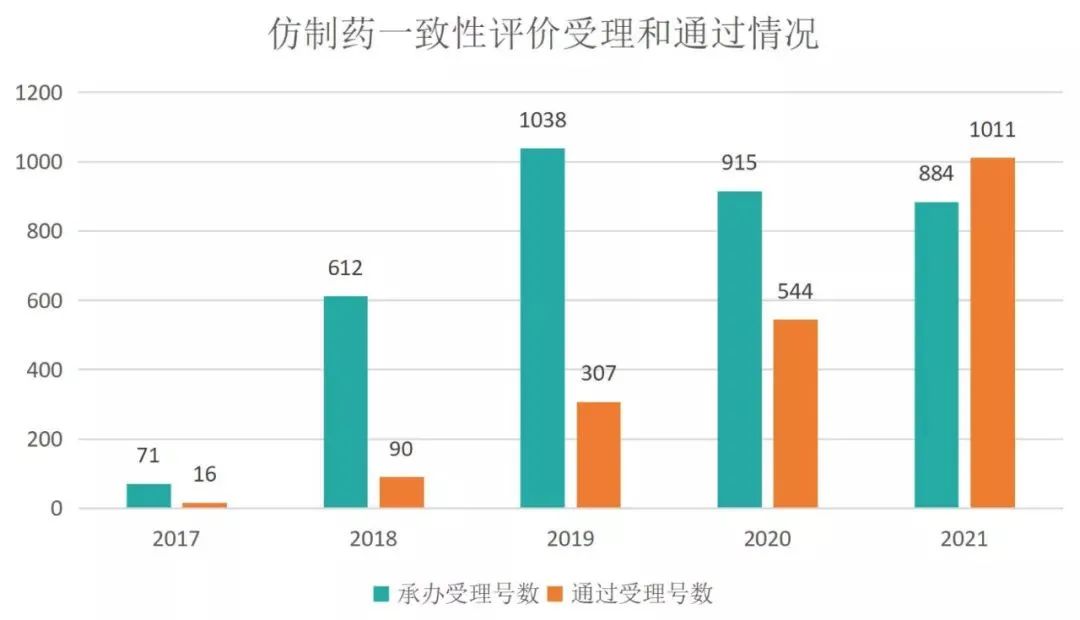
图1 仿制药一致性评价受理和通过情况
2021年承办的884个一致性评价受理号中:注射用头孢呋辛钠最多,受理号数量为28个;其次为射用头孢西丁钠,受理数量为20个。2021年进入承办的一致性评价品种排名前10均为注射剂。有两个方面的原因:一方面是注射一致性评价政策落地,各企业争相申报;另一方面是口服固体制剂在前几年基本申报得差不多了。

表2 2021年一致性评价品种申报TOP10
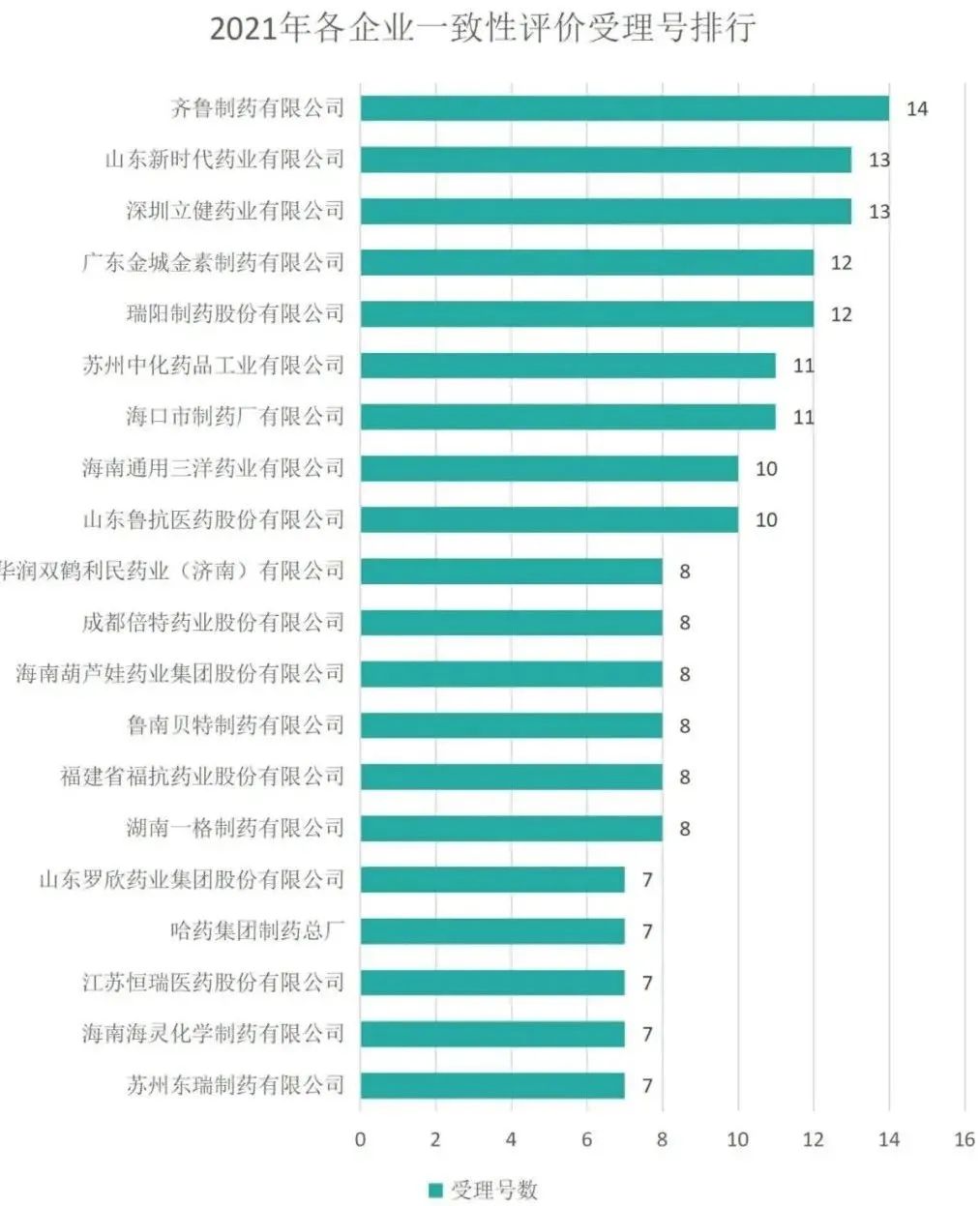
2021年,共有363家企业一致性评价品种进入受理,不过有175家企业均只新增了1个受理号。受理号最多的是齐鲁制药有限公司,新增14个受理号;其次是山东新时代和立健药业,受理号新增13个(本处统计未按母子企业汇总)。
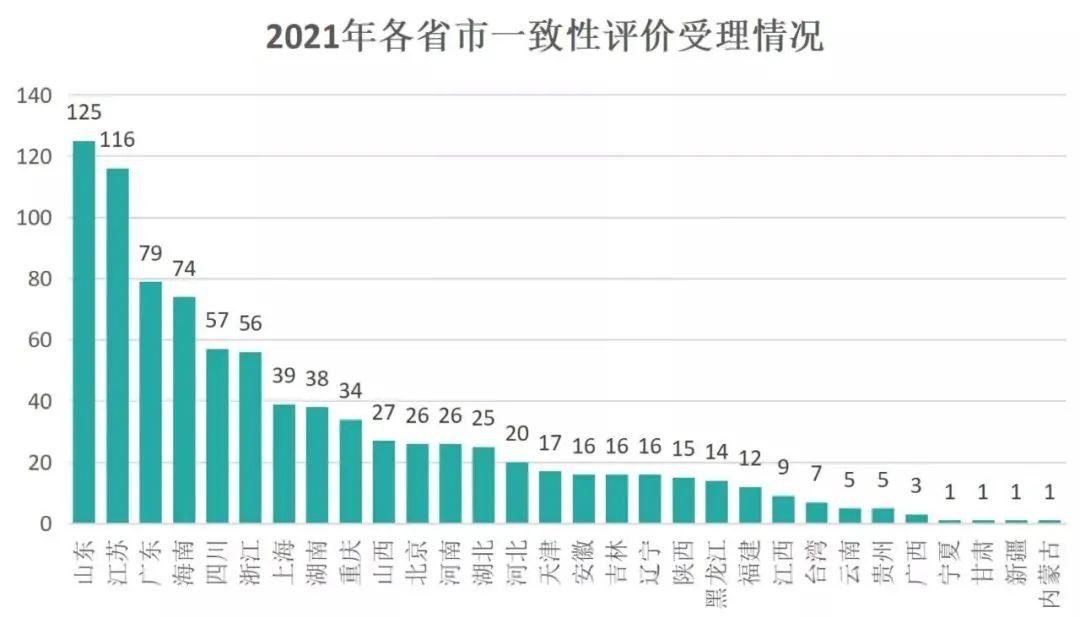
2021年,共有30个省市的一致性评价品种进入受理。受理号最多的是山东省,达到125个受理号;其次是江苏省,达到116个受理号,广东排名第三,受理号数为79个。
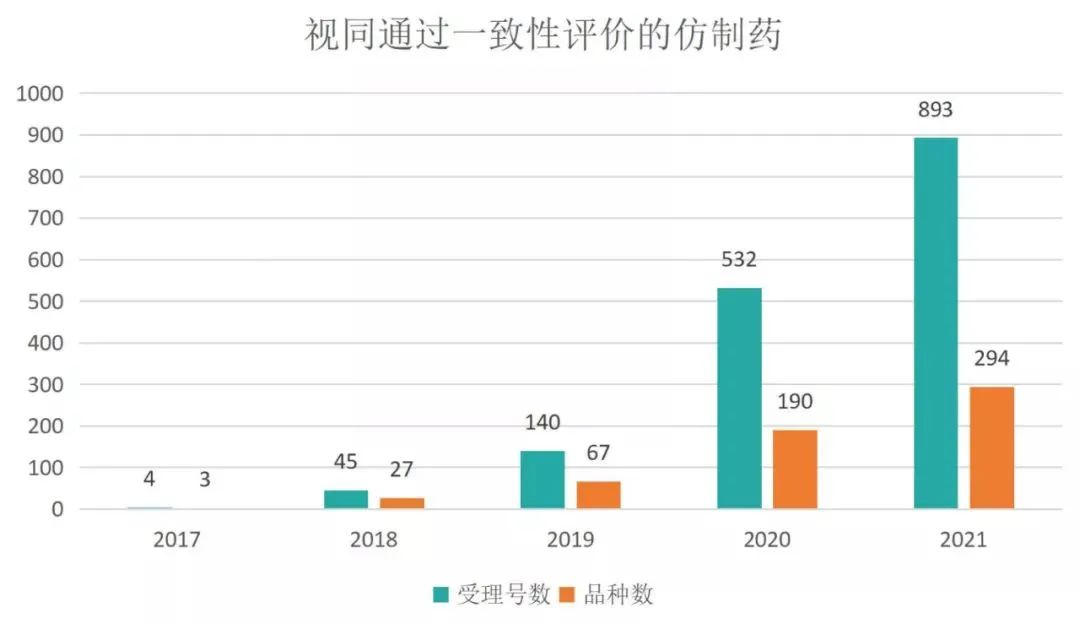
据统计,视同通过仿制药一致性评价(按化学药品新注册分类批准的仿制药)的受理号累计达到1614个,其中中国上市药品目录集收录了1357个。2021年,新增视同通过一致性评价受理号893个,同比增加67.9%,共计294个品种。
药品通过方面来说,已有415个品规一致性评价通过企业数达到3家,通过企业数最多的是5mg的苯磺酸氨氯地平片,通过企业数达到50个;其次是阿莫西林胶囊,通过企业数为35个;0.25g的盐酸二甲双胍片排名第三,达到33个企业。总体来说,大部分品种的竞争仍然激烈。从一致性评价各品规通过企业数3家及以上的分布来看,绝大部分只有3家到4家,累计占比46%。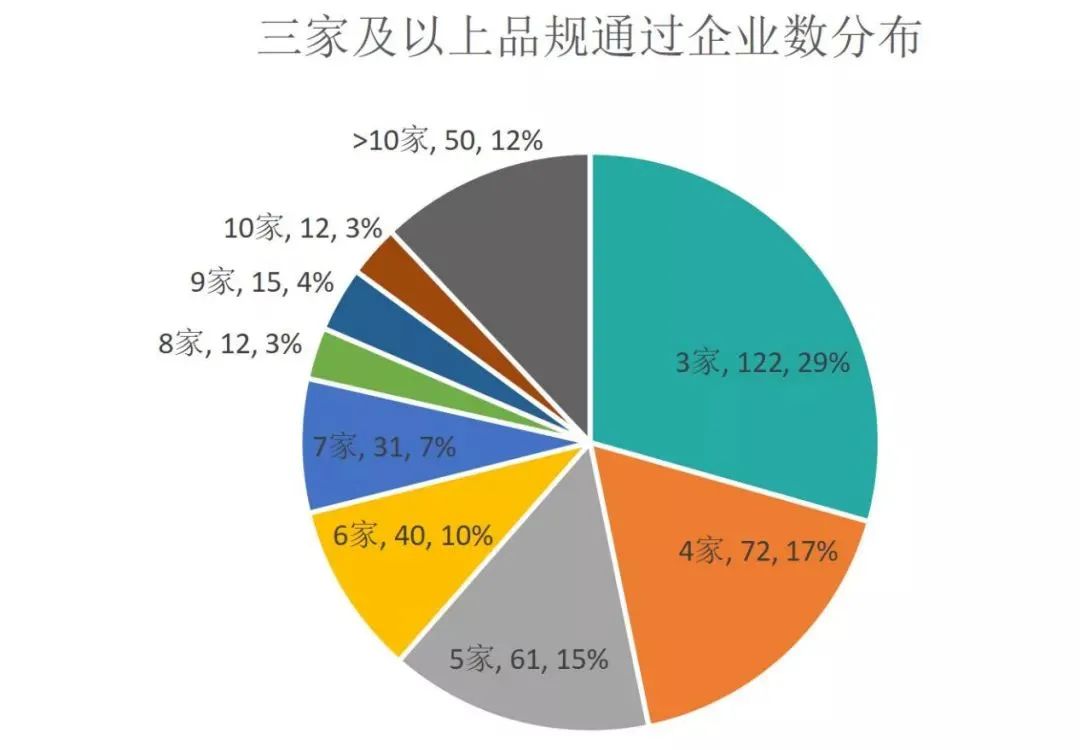
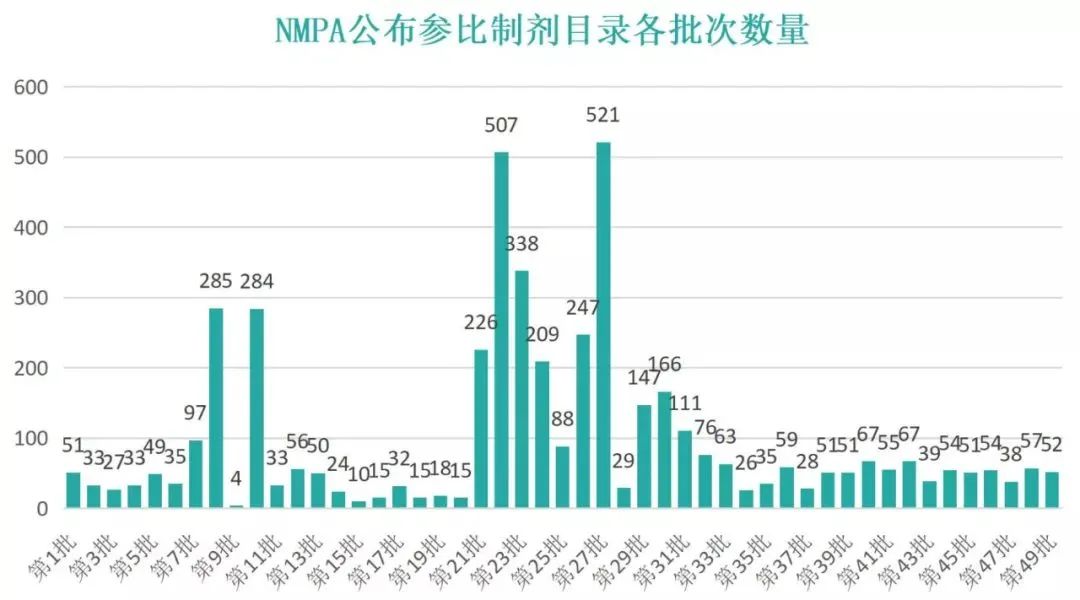
国家药监局已累计发布参比制剂目录49批,共计4686条,其中注射剂参比制剂1254条。2021年,NMPA共发布参比制剂目录14批,共计723条;第23批发布数量最多,单次达到521条。
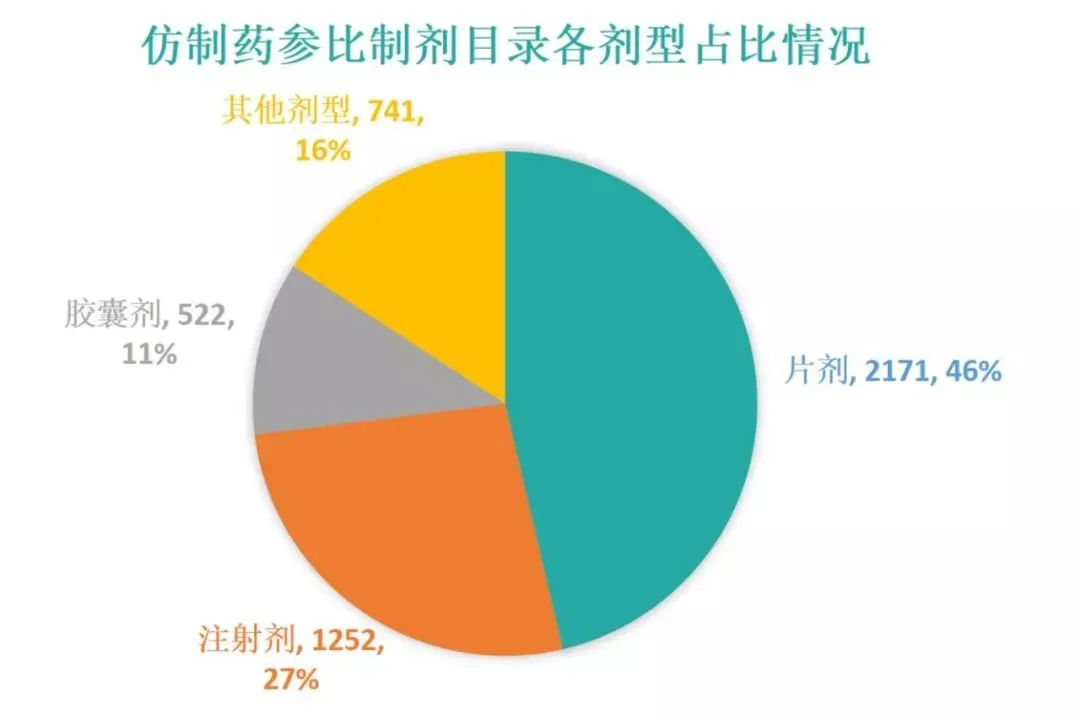
49批参比制剂中,最多的剂型是片剂,共计2171条,占比46.3%;其次是注射剂,占比26.7%。注射剂首次出现在第21批,共计163条。
2021年,第四批、第五批国家集中采购落地,多省出台招采政策鼓励过评。随着注射剂一致性评价大量通过,2021年迎来了密集收获期。此外,仅有758个仿制药一致性评价受理号在审评审批中,仿制药一致性评价即将进入收尾阶段。数据来源:戊戌数据、中国上市药品目录集、国家药监局、上市公司公告。