2017年12月22日,CDE组织起草了《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,那么。注射剂参比制剂遴选技巧及常见误区有哪些?且随小编一起去看看吧!
2017年12月22日,CDE组织起草了《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,向社会公开征求意见。
“征求意见稿”对参比制剂的选择描述如下:
作为参比制剂的原研产品应具有完整和充分的安全性、有效性数据作为上市依据,符合以上要求的,建议企业按以下顺序选择参比制剂:
(一)首选国内上市的原研药品;如原研药品国内未上市,应选择欧美日已上市的原研药品(对于多个国家/地区的,建议依次选择在美国、欧盟和日本已批准上市的)。如果原研药品在国外上市的处方不一致,申请人按照现有技术要求进行评估,选择更合理的原研药品。
(二)在原研企业停止生产的情况下,可选择美国橙皮书标识为RS的药品。
(三)对参比制剂选择有疑义的(专利问题除外),可与总局一致性评价办公室讨论确定。
结合之前口服固体制剂的参比制剂遴选原则,注射剂的参比制剂倒是比较清晰和简单。总的来说就是在满足安全性有效性的基础上,优先选择国内上市的原研药品,包括原研进口和原研地产化;其次选择国外上市的原研药品;原研企业停产再选择RS。
笔者最近对参比制剂进行了梳理,也有些感触,就遴选技巧和常见误区发表一下拙见。
遴选技巧
1、充分利用进口药品数据库,必要时追溯其注册信息。
2、根据上市时间初判原研企业,重点看美国、欧盟(成员国)、日本各国的上市时间。
3、日本IF文件“开发经过”部分会提到原研情况。
4、专利许可,共同开发,市场许可等需要注意区分,英文:Originator、Licensee、marketed等。
5、企业与企业之间的关系需要厘清,尤其是收购、合并等。比如:Hoechst Marion Roussel (subsequently Aventis, now Sanofi) and Fujisawa(now Astellas)。
6、参考其他企业的参比制剂备案信息。
常见误区
1、化合物原研与制剂原研混淆不清。
2、忽略原研地产化品种。
3、注射用xxx和xxx注射液要区分开。
举例说明:多西他赛注射液
1、利用药智数据综合检索,查看该注射剂的信息,重点关注市场信息。

2、进入进口药品数据库查看公司名称,规格、进口国家等信息,获取注射剂英文名称(如果已知英文名称可省略)。
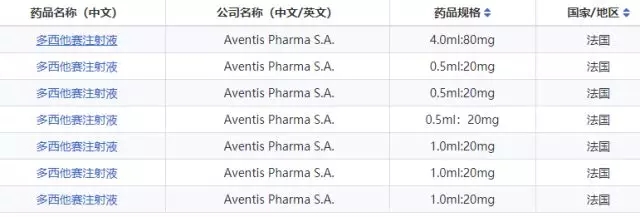
3、确定进口企业是否为原研企业,有两种判定方法:a、根据上市时间进行判定;b、利用“全球药品研发数据库”的原研企业栏目查看化合物原研予以佐证。
为保证查询信息更全面,建议使用中/英活性成分进行检索,即多西他赛/docetaxel。
查询结果:
a、美国FDA有51条信息,其中SANOFIAVENTISUS最早上市,时间为1996年05月14日。b、欧盟EMA有9条信息,其中Aventis Pharma S.A.最早上市,时间为1995年11月27日。C、日本PMDA有40条信息,其中サノフィ株式会社(赛诺菲有限公司)最早上市,时间为1997年6月。由此,基本可以判定Aventis是原研企业。
同时,“全球药品研发数据库”也查到原研企业为Aventis Pharma。

4、可通过其他数据来源进行进一步确定,如日本IF文件中也提到多西他赛最初由赛诺菲研发。

5、查询国产药品是否有该品种的地产化品种,可以看到37个多西他赛注射液批文均隶属国内企业。
综上所述:
多西他赛注射液参比制剂选择有法国进口的TAXOTERE(泰索帝),公司名称Aventis Pharma S.A,规格为:0.5ml : 20mg、1.0ml : 20mg、4.0ml : 80mg。
国内特有的1.5ml : 60mg则需要改规格;而国内2.0ml : 80mg的参比制剂则需要选择欧盟上市的Taxotere。另外,欧盟和美国还有160mg / 8ml规格的多西他赛注射液。
多西他赛注射液的参比制剂选择相对来说比较简单,部分品种需要追溯历史审批信息,查阅资料。本文对原研地产化品种、美欧日上市及美国橙皮书RS品种不再作举例分析。