药物一致性评价,即药品一致性研究,就是仿制药必须和原研药“管理一致性、中间过程一致性、质量标准一致性等全过程一致”的高标准要求。《国家药品安全“十二五”规划》(下称“《规划》”)明确要求的未通过药品质量一致性评价的仿制药将不予再注册和注销其药品批准证明文件。
仿制药和原研药、名牌药和小厂药、国产药和进口药,一样的药品,杂质的含量可能不一样,生物利用度不一样,副作用有差别,临床上的安全性和有效性自然就不同。所以必须进行药物一致性研究,才能提高药品的安全性和有效性,保障人民用药安全、有效。
在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。包括处方、质量标准、晶型、粒度和杂质等主要药学指标比较研究,以及固体制剂溶出曲线的比较研究,以提高体内生物等效性试验的成功率,并为将药品特征溶出曲线列入相应的质量标准提供依据。对符合《人体生物等效性试验豁免指导原则》(食品药品监管总局通告2016年第87号)的品种,由药品生产企业申报,一致性评价办公室组织审核后公布,允许该药品生产企业采取体外溶出试验的方法进行一致性评价。
对于开展生物等效性试验的品种,应根据《关于化学药生物等效性试验实行备案管理的公告》(食品药品监管总局公告2015年第257号)规定的程序备案,并按照《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》(食品药品监管总局通告2016年第61号)等的有关要求进行试验研究。
对无参比制剂需开展临床有效性试验的品种,区分两种情况处理:
(1)如属于未改变处方、工艺的,应按一致性评价办公室的要求进行备案,并按照有关药品临床试验指导原则的相应要求开展试验研究;
(2)如属于改变已批准处方、工艺的,按照《药品注册管理办法》补充申请有关要求开展试验研究。
按照国务院文件的要求,仿制药要进行质量和疗效的一致性评价,在2016年CFDA也密集颁布了很多关于一致性评价的政策、法规及指导原则,并组织了多场的专业培训及政策宣讲,一致性评价对众多制药企业就像当初的GMP改造一样,是不得不进行的事情,绝大多数化药品种的一致性评价包括药学和生物等效性两项研究;但是对一些不能无法找到参比制剂或者无法进行生物等效性研究的特殊品种还需要进行临床有效性的试验。
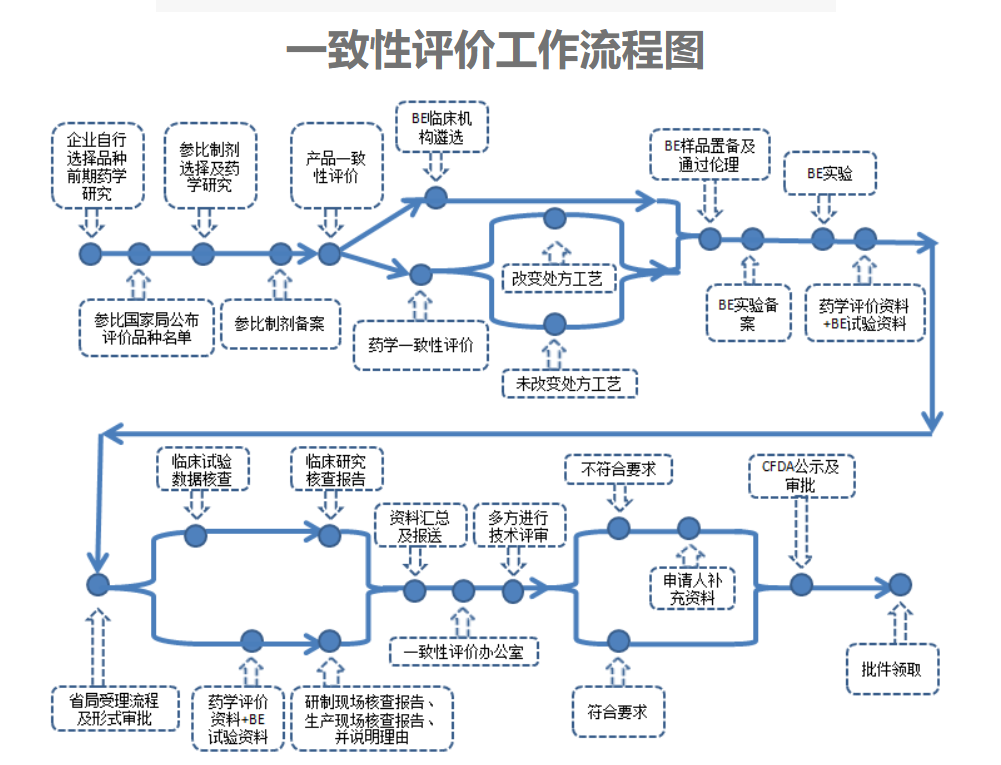
药品一致性评价流程图如下:
桐晖药业提供仿制药的一致性评价服务,桐晖药业,你将可以获得以下优势:
优势一、最新技术标准
我公司联盟合作药学研究实验室,具有良好的试验设备、具有满足一致性评价所需的溶出仪、高效液相等试验设备,近年来一直从事新药及仿制药的研发,具有丰富的研发经验,拥有稳定的科研团队,能够很好地帮客户完成一致性评价的药学研究。并且严格按照RCFDA领布的最新的各项要求来进行一致性评价的药学和生物等效性研究(CMC&BE),保证项目运行。
优势二、丰富的BE及临床项目经验
我司提供过很多仿制药BE研究及新药临床试验的CRO服务,积累了丰富的项目研究及监查管理的经验,严格按照最新的核查标准及技术要求制定了质量管理体系及SOP,并严格要求按照质量管理体系及SOP进行项目的组织、协调、监查及管理等服务,保证项目运行的质量。
优势三、一站式的服务、上百家临床机构任君选择
与国内多家临床机构建立了良好的合作关系,切实的为客户提供一站式到点服务。并且对各家机构的特点优势了然于胸,有信心能为每一位客户筛选出最合适的单位进行合作。